Masing-masing atom hidrogen mempunyai 1 elektron dan untuk mencapai konfigurasi oktet yang stabil seperti unsur golongan gas mulia maka masing-masing atom hidrogen memerlukan tambahan 1 elektron. Tambahan 1 elektron untuk masing-masing atom hidrogen tidak mungkin didapat dengan proses serah terima elektron karena keelekronegatifan yang sama. Sehingga konfigurasi oktet yang stabil dpat dicapai dengan pemakaian elektron secara bersama. Proses pemakaian elektron secara bersama terjadi dengan penyumbangan masing-masing 1 elektron ari atom hidrogen untuk menjadi pasangan elektron milik bersama. Pasangan elektron bersama ditarik oleh kedua inti atom hidrogen yang berikatan.
Menurut aturan Oktet dan Lewis, pembentukan pasangan elektron harus menghasilkan konfigurasi elektron sepperti gas mulia, yaitu 8 elektron untuk Helium (He).
1. Simbol Lewis
Simbol Lewis adalah lambang atom dengan elektron valensinya yang digambarkan sebagai titik-titik elektron, dimana setiap elektron valensi dituliskan dengan satu titik. Sehingga penulisan jumlah titik elektron disesuaikan dengan elektron valensi yang dimiliki atom.
2. Rumus Kimia Senyawa Kovalen Biner
Berdasarkan aturan Oktet, kita dapat menuliskan rumus kimia senyawa kovalen biner, yaitu dengan caramenjumlahkan elektron valensi antara atom-atom yang berkaitan sehingga membentuk pasangan elektron dan memenuhi kaidah oktet.
3. Struktur Lewis dari Senyawa Kovalen
Struktur Lewis dari senyawa kovalen menggambarkan pembentukan pasangan elektron yang terjadi antara atom-atom yang diperoleh dari penjumlahan elektron valensi atom-atom tersebut sehingga membentuk konfigurasi yang stabil.
JENIS-JENIS IKATAN KOVALEN
1. Ikatan Kovalen Tunggal
Ikatan kovalen tunggal adalah ikatan antara dua atom unsur yang sama/berlainan, dimana masing-masing atom saling memberikan satu elektron sehingga merupakan satu pasang elektro ikatan.
Misalnya;
a. Antara atom H dan atom H
masing-masing membutuhkan satu elektron untuk mencapai struktur gas mulia terdekat, yaitu Helium menjadi H2.2, Ikatan Kovalen Rangkap
Pada ikatan ini masing-masing unsur sama/berlainan, saling memberikan 2 elektron, sehingga 2 PEI, agar mencapai struktur Ne (oktet).
Misalnya;
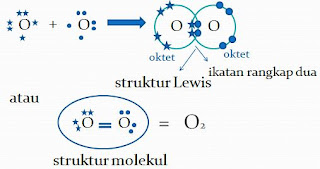
a. Antara atom O dengan atom O
Konfigurasi O : 2 6
Konfiguarsi Ne : 2 8
Masing-masing atom O saling meminjamkan 2 elektron, sehingga terbentuk 2 PEI, untuk menyamai struktur Ne.3. Ikatan Kovalen Ganda Tiga
Ikatan kovalen ganda tiga adalah ikatan dari masing-masing atom unsur yang sama/berlainan, saling memberikan 3 elektron, agar mencapai struktur Ne (oktet).
Misalnya;
a. Antara atom N dengan atom N
Konfigurasi N : 2 5
Konfigurasi Ne : 2 8
Masing-masing atom N saling meminjamkan 3 elektron, untuk menyamai struktur Ne.4. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan kovalen yang pasangan elektron milik bersamanya berasal dari satu atom.
Misalnya molekul air (H2O) dengan anion H+ di dalam air. Pada molekul H2O, 2 atom H dan 1 atom O saling memberikan satu elektron untuk dipakai bersama se hingga terbentuk 2 PEI karena atom H = 2, sedangkan 6 dari elektron atom O masih tinggal 6 elektron (6 - 2 = 4) yang merupakan 2 pasangan elektron bebas (PEB) yang tak terkait.
Konfigurasi H = 1
Konfigurasi O = 2 6
Konfigurasi He = 2
Konfigurasi Ne = 2 8
SIFAT-SIFAT SENYAWA KOVALEN
1. Polar, jika atom yang berikatan memiliki perbedaan harga keelektronegatifan (misalnya molekul HCl, H2O, NH3).
Nonpolar, jika atom yang berikatan mempunyai harga keelektronegatifan yang sama (misalnya molekul H2, O2, N2).. Sekian dulu Artikel tentang Ikatan Kovalen .
. dan semoga bermanfaat .









Tidak ada komentar:
Posting Komentar